ΘΕΜΑΤΑ ΕΠΑΝΑΛΗΨΗΣ ΣΤΗ ΧΗΜΕΙΑ Γ ΛΥΚΕΙΟΥ
1) ΔΙΑΜΟΡΙΑΚΕΣ ΔΥΝΑΜΕΙΣ-ΩΣΜΩΤΙΚΗ ΠΙΕΣΗ
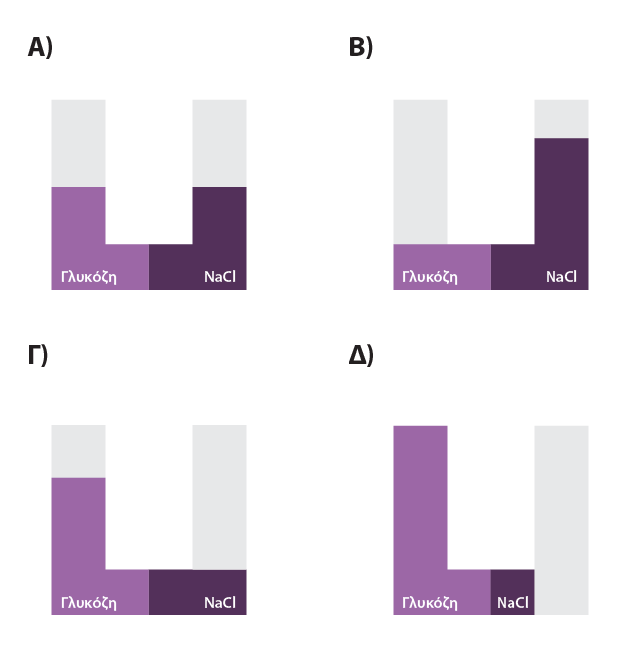
1) ΄Ισοι όγκοι υδατικών διαλυμάτων γλυκόζης C6H12O6 1Μ και χλωριούχου νατρίου NaCl 1Μ τοποθετούνται στις δύο πλευρές ημιπερατής μεμβράνης σε σωλήνα σχήματος U. Μετά την αποκατάσταση της ισορροπίας, η εικόνα που βλέπουμε είναι:
AΠ. Σωστή είναι η Β.
Το ΝaCl διίσταται: ΝaCl(s) image002.gif Na+(aq) + Cl-(aq)
1M 1M 1M
Στο δ/μα ΝaCl η συγκέντρωση των διαλυμένων σωματιδίων είναι Cολ=1Μ+1Μ=2Μ, ενώ στο δ/μα της γλυκόζης C=1M. Επομένως τα μόρια του νερού θα περάσουν από το αραιότερο (γλυκόζη) προς το πυκνότερο (ΝaCl) δ/μα, μεχρι να εξισωθούν οι δύο συγκεντρώσεις.
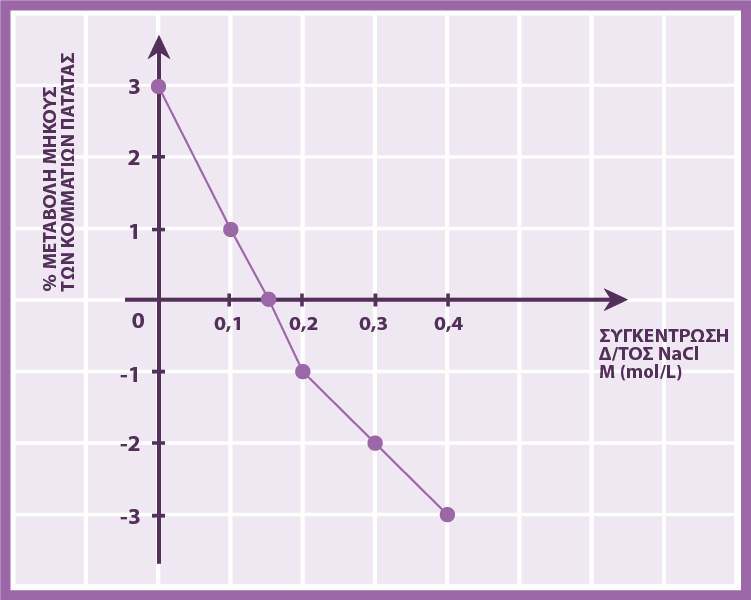
2) Διαθέτουμε 5 ποτήρια ζέσεως των 200ml . Σε κάθε ένα τοποθετούμε αντίστοιχα νερό, υδατικό δ/μα ΝaCl 0,1M, 0,2M , 0,3M , 0,4M.
Κόβουμε κομμάτια πατάτας, ίδιου μήκους και διατομής, και τα τοποθετούμε μέσα στα παραπάνω διαλύματα. Αφού περάσει μία ώρα, αφαιρούμε τα κομμάτια .
Κατασκευάζουμε την παρακάτω γραφική παράσταση:
Δικαιολογήστε τα αποτελέσματα.
ΑΠ.
Στα δ/τα με C < 0,15M αυξήθηκε το μήκος των κομματιών πατάτας επειδή τα μόρια του νερού πέρασαν , λόγω ώσμωσης , από το δ/τα στο εσωτερικό της πατάτας. Επομένως, τα δ/τα αυτά είναι υποτονικά (αραιότερα) σε σχέση με το εσωτερικό της πατάτας.
Στα δ/τα με C > 0,15M μειώθηκε το μήκος των κομματιών επειδή η ώσμωση πραγματοποιήθηκε από τις πατάτες στο δ/μα. Επομένως τα δ/τα αυτά είναι υπερτονικά (πυκνότερα) σε σχέση με το εσωτερικό της πατάτας.
Στο δ/μα με C = 0,15M δεν έγινε ώσμωση, άρα αυτό είναι ισοτονικό δηλ. έχει ίδια molarity με το εσωτερικό της πατάτας.
3) Στα παρακάτω ζεύγη, ποιο μόριο έχει την χαμηλότερη τάση ατμών;
α) CH3COOH-C2H6
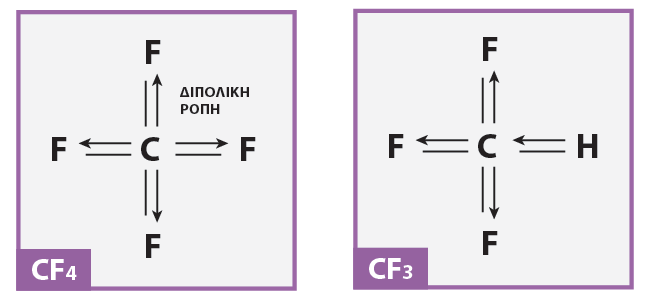
β) CHF3 – CF4
γ) C20H42 – C30H62
δ) Βr2 – I2
ΑΠ. Ισχυρές διαμοριακές δυνάμεις έχουν ως αποτέλεσμα τα μόρια να «δραπετεύουν» με δυσκολία από την υγρή στην αέρια φάση, άρα να εμφανίζουν χαμηλή ατμών.
Αντίθετα, υψηλή τάση ατμών σημαίνει ασθενείς διαμοριακές δυνάμεις .
Επομένως , για τα παραπάνω ζεύγη, την χαμηλότερη τάση ατμών θα έχει:
α) Το CH3COOH : ύπαρξη δεσμού Υδρογόνου μεταξύ των μορίων, άρα ισχυρές διαμοριακές δυνάμεις, χαμηλότερη τάση ατμών από τα μόρια C2H6 που συγκρατούνται με δυνάμεις London.
β) Το CHF3 : πολικά μόρια άρα υπάρχουν δεσμοί διπόλου-διπόλου μεταξύ τους που είναι ισχυρότεροι από τις δυνάμεις London μεταξύ των μη πολικών μορίων CF4 (είναι συμμετρικό μόριο και οι διπολικές ροπές εξουδετερώνονται)
γ) Το C30H62 : μόρια με μεγαλύτερη σχετική μοριακή μάζα από τα C20H42 , άρα εμφανίζουν ισχυρότερες δυνάμεις London μεταξύ τους.
δ) Το I2 : μόρια με μεγαλύτερη σχετική μοριακή μάζα από τα Βr2 , άρα εμφανίζουν ισχυρότερες δυνάμεις London μεταξύ τους.